cód. #4517
INEP - Química - 2014 - Exame Nacional do Ensino Médio - Primeiro e Segundo Dia - PPL
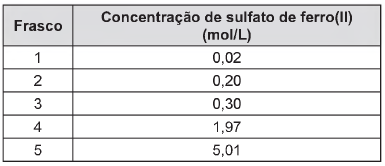
Água dura é aquela que contém concentrações relativamente altas de íons Ca2+ e Mg2+ dissolvidos. Apesar de esses íons não representarem risco para a saúde, eles podem tornar a água imprópria para alguns tipos de consumo doméstico ou industrial. Objetivando reduzir a concentração de íons Ca2+ e Mg2+ de uma amostra de água dura ao mínimo possível, um técnico em química testou os seguintes procedimentos no laboratório:
I - Decantação da amostra de água.
II - Filtração da amostra de água.
III - Aquecimento da amostra de água.
IV - Adição do solvente orgânico CCl4 à amostra de água.
V - Adição de CaO e Na2CO3 à amostra de água.
BROWN, T L. et al. Química, a ciência central. São Paulo: Pearson Prentice Hall, 2005 (adaptado).
O método considerado viável para tratar a água dura e aumentar seu potencial de utilização é o(a)
A) decantação, pois permite que esses íons se depositem no fundo do recipiente.
B) filtração, pois assim os íons Ca2+ e Mg2+ são retidos no filtro e separados da água.
C) aquecimento da amostra de água, para que esses íons sejam evaporados e separados.
D) adição do solvente orgânico CCl4 à amostra, para solubilizar esses íons e separá-los da água.
E) reação química com CaO e Na2CO3, para precipitar esses íons na forma de compostos insolúveis.
A
B
C
D
E



 2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.
2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica.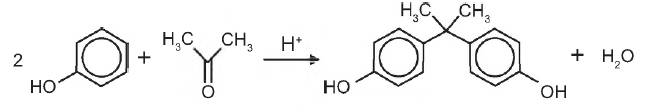

 5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)
5 Ca2+ (aq) + 3 PO43- (aq) + OH- (aq)